"אחת הקפיצות הגדולות בביו-רפואה": בריטניה אישרה טיפול בעריכה גנטית
"אחת הקפיצות הגדולות בביו-רפואה": בריטניה אישרה טיפול בעריכה גנטית
הרגולטור הבריטי הוא הראשון בעולם לספק אישור לטיפול מבוסס עריכה גנטית ■ הטיפול החד-פעמי נועד לשתי מחלות דם תורשתיות, אך הוא אינו מהיר או פשוט - ויידרשו שנים ארוכות כדי להבין את מלוא ההשפעות הביולוגיות שלו על המטופלים
November 19th, 12PM November 19th, 15PM רותי לויהרגולטור בבריטניה אישר ביום חמישי תרופה שמבוססת על מערכת עריכת הגנים קריספר (CRISPR) לטיפול במחלות דם תורשתיות מסוג אנמיה חרמשית וביטא תלסמיה - שתי מחלות שפוגעות בייצור ההמוגלובין המשמש את תאי הדם האדומים לשאת חמצן ברחבי הגוף. בכך הופכת התרופה - קאסגבי (Casgevy) - לטיפול הראשון בעולם שנבנה על טכנולוגיית עריכת הגנים המהפכנית, שהתגלתה לפני קצת יותר מעשור וזיכתה את המדעניות שגילו אותה בפרס נובל לכימיה ב-2020.
מומחים מגדירים את האירוע כאחת הקפיצות הגדולות ביותר בחדשנות הביו-רפואית מאז שנות ה-80. "עריכה גנטית עשויה להגדיר מחדש את הרפואה ב-40-30 השנים הבאות, והאישור הזה הוא תחילתו של השינוי", אמר לתקשורת סמארת' קולקרני, מנכ"ל חברת CRISPR Therapeutics השווייצית, שפיתחה את התרופה יחד עם ורטקס (Vertex Pharmaceuticals) האמריקאית. קריספר תרפיוטיקס נוסדה על ידי חתנית פרס נובל עמנואל שרפנטייה שפירסמה ב-2012, יחד עם ג'ניפר דאודנה, את המאמר פורץ הדרך על עריכת גנים אנושיים במבחנה עם קריספר.
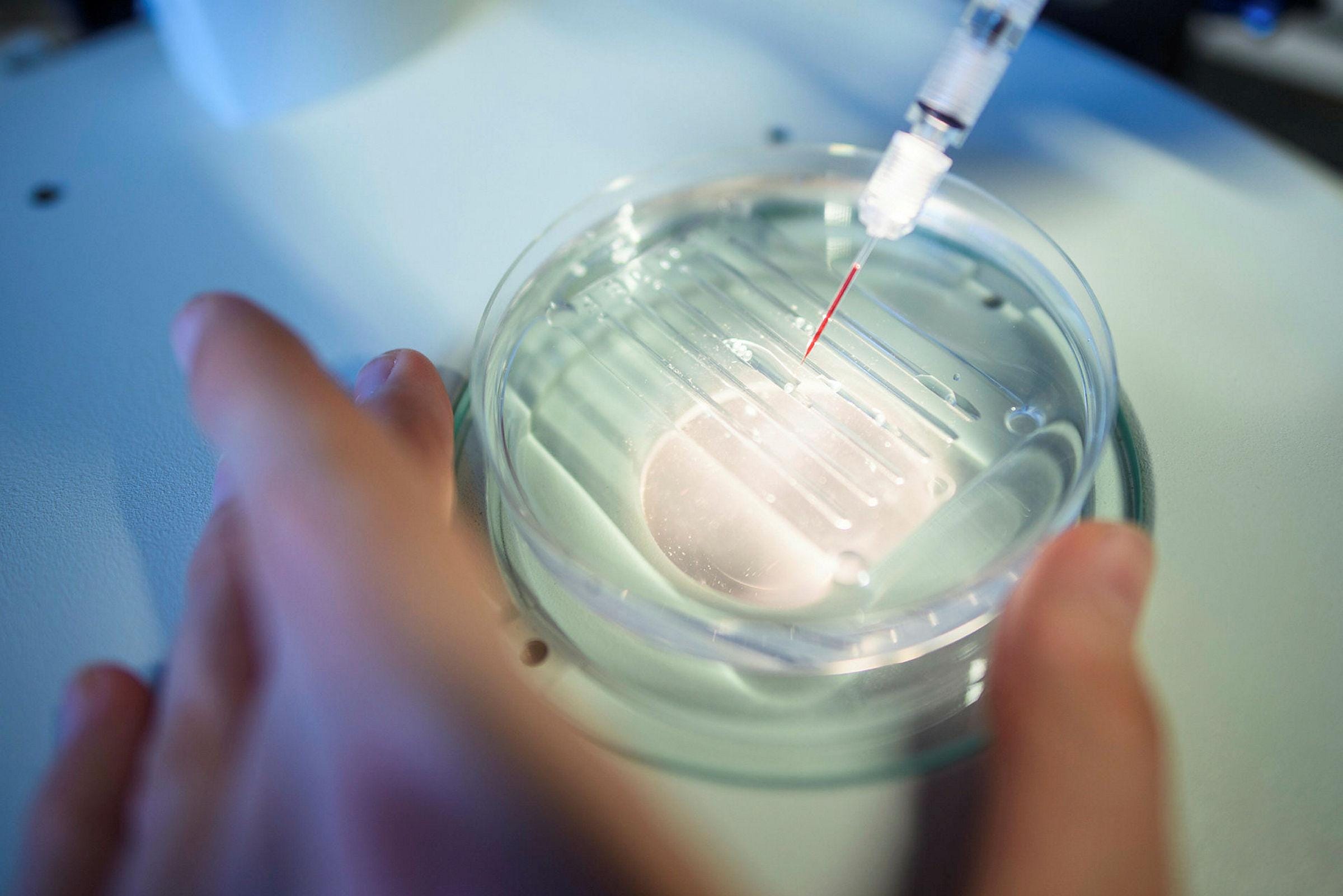
קריספר היא שיטה לשינוי אזורים ספציפיים של דנ"א. באנלוגיה פשוטה, מדובר במקשי ה-Cut וה-Paste של אותיות הדנ"א המאפשרים לחתוך כל מקטע דנ"א שרוצים, ואז לאפשר לגנום לתקן את החסר בעצמו או להחדיר את מקטע הגנום הרצוי במקום שנחתך. הקריספר הוא אזור בדנ"א של החיידקים שמספק להם הגנה מפני וירוסים. חיידקים שפוגשים בנגיפים אויבים ומצליחים להתגבר עליהם, מאחסנים חלקים מהדנ"א של הנגיף כדי שיוכלו לחתוך את הגנים של נגיפים כמותו ולהתגונן מפניהם גם בעתיד.
דאונדה ושרפנטייה הצליחו לרתום את המנגנון הזה לעריכה גנטית של כל ישות בעלת גנום. הן לא גילו את הקריספר עצמו, אלא הפכו את המערכת המורכבת ליעילה ובעלת שני מרכיבים - חלבון Cas9 לחיתוך דנ"א ורנ"א שמנחה אותו לנקודה שרוצים לחתוך. במאמרן המפורסם הן הסבירו כיצד תיכנתו את מערכת חיתוך הדנ"א של חיידקים חד-תאים בשם סטרפטוקוקוס פיוג'נס כך שתהיה מסוגלת לחתוך כל דנ"א בעולם - ויצרו למעשה מספריים מולקולריות. הן גם הראו איך להחדיר באמצעות רנ"א מקטע גנטי רצוי במקום זה שנחתך.
החידוש של השתיים הפך את המנגנון לפשוט, זול ונגיש בהרבה משיטות אחרות לעריכה גנטית שהיו קיימות עד אז. עד לקריספר חוקרים ידעו לבצע סוגים שונים של חיתוכים ועריכות דנ"א אך רק במבחנה מחוץ לתא החי, ואילו קריספר מאפשרת להנדס תאים חיים במהירות ולהמשיך לבצע בהם ניסויים. המנגנון נמצא בשימוש כמעט בכל ניסוי ביולוגי, ואיפשר, בין השאר, לפענח את הפונקציונליות של גנים שפעולתם לא הייתה ידועה קודם לכן על ידי מחיקתם.
המנגנון נמצא בשימוש כמעט בכל ניסוי ביולוגי, ואיפשר, בין השאר, לפענח את הפונקציונליות של גנים שפעולתם לא הייתה ידועה קודם לכן על ידי מחיקתם
ריפוי מבוסס קריספר כבר נמצא בניסויים כנגד מחלות רבות כמו ניוון שרירים, עיוורון גנטי, איידס וסרטן הדם. אך ריפוי הוא רק צד אחד של הקרסיפר. באמצעות מנגנון העריכה הגנטית הצליחו חוקרים לטפל בעמידות חיידקים לאנטיביוטיקה, לייצר ערכות בדיקה לקורונה, לקדם השתלות לבני אדם מאיברים של חזירים, חוקרים ישראלים מחברת Poultry NRS והמכון הוולקני רתמו את המנגנון כדי למנוע מתרנגולות להטיל ביצים עם אפרוחים זכרים וכך למנוע השמדה המונית שמתרחשת בלולים.
"יותר ממה שאי פעם חלמתי עליו"
חולי אנמיה חרמשית, מחלה הנפוצה יותר בקרב אנשים ממוצא אפריקאי, מתמודדים עם התקפי כאב עזים וחשופים לזיהומים ונזק לאיברים; ואילו ביטא תלסמיה מתבטאת באנמיה חריפה ומסכנת חיים אשר דורשת עירויי דם קבועים, אחת ל-3-5 שבועות. ניסויים קליניים בקאסגבי, שנקראית גם אקסה-סל (exa-cel), הראו כי הטיפול החד פעמי משחזר ייצור המוגלובין בריא ברוב המטופלים. הוא איפשר לחולי אנמיה חרמשית רבים לחיות ללא כאבים, והקל על חולי תלסמיה מהצורך לקבל עירויי דם בקביעות, אם כי מדובר בתוצאות ביניים שהמסקנות שלהן נסמכות על השלמת שנה אחת מקבלת הטיפול. הסוכנות הרגולטורית לתרופות ומוצרי בריאות בבריטניה (MHRA) אישרה את הטיפול לחולים בני 12 ומעלה, וציינה כי לא זוהו חששות בטיחותיים משמעותיים במהלך הניסויים, וכי הרשות תעקוב מקרוב אחר בטיחות התרופה בשנים הבאות.
ב"ניו יורק טיימס" הביאו את סיפורה של המטופלת הראשונה בקאסגבי, ויקטוריה גריי. עובדת וולמרט שאובחנה עם אנמיה חרמשית בגיל שלושה חודשים וסבלה מהתקפי כאב שהובילו לאשפוזים תכופים. "לא יכולתי להגשים הרבה מהחלומות שלי", אמרה. "הדברים הכי קטנים - מזג אוויר קר או משתנה - הובילו אותי לבית החולים". גריי עברה את הטיפול ב-2019, כשהייתה בת 33, ומספרת כי מאז כל הסימפטומים שהיו לה נעלמו. "זו הייתה התחלה חדשה עבורי, וזה יותר ממה שאי פעם חלמתי עליו".
החסם הכלכלי עוד לא נפתר
לפי אתר הביוטק האמריקאי STAT, מינהל המזון והתרופות האמריקאי (FDA) אמור להכריע לגבי גורל התרופה בארה"ב עד תחילת דצמבר עבור חולי אנמיה חרמשית, ועד סוף מרץ עבור חולי תלסמיה. גם אחרי האישור, הגישה לטיפול מסוג זה אינה מהירה, היצרניות עוד לא קבעו מחיר מחירון עבור התרופה. טיפול חד-פעמי מסוג זה יעלה כנראה קרוב ל-2 מיליון דולר ומערכות הבריאות וחברות הביטוח נרתעות מהמחירים הגבוהים האלה בטענה שהיתרונות ארוכי הטווח של טיפולים חד-פעמיים טרם הוכחו.
ורטקס כבר מסוכסכת עם הרגולטור הבריטי בנוגע לתמחור התרופה שלה לסיסטיק פיברוזיס. וחברה אחרת שזכתה לאישור לטיפול גנטי לתלסמיה בבריטניה בשנה שעברה - בלובירד ביו (Bluebird Bio) - הפסיקה את הפעילות שלה באירופה לאחר אי הסכמה בנוגע למחירי הטיפולים שלה.
טיפול חד-פעמי מסוג זה יעלה כנראה קרוב ל-2 מיליון דולר ומערכות הבריאות וחברות הביטוח נרתעות מהמחירים הגבוהים האלה בטענה שהיתרונות ארוכי הטווח טרם הוכחו
בכל מקרה, מדובר בטיפול שדורש היערכות ואנשי מקצוע מיומנים, ולא בתרופה שניתן להזריק או לבלוע בקלות - כך שהוא צפוי להתקבל רק במדינות עשירות עם מערכות בריאות מפותחות, שגם כך מוציאות הוצאות כבדות על חולים אלה.
לפי הערכות של בלומברג, מכירות קאסגבי לא צפויות להגיע למיליארד דולר עד 2027. לשם השוואה, התרופה של ורטקס לסיסטיק פיברוסיס צפויה לדווח השנה על כ-10 מיליארד דולר במכירות. במסגרת הסכם שיתוף הפעולה ביניהן, הרווחים שיתקבלו מהמכירות יתחלקו 60%-40% לטובת ורטקס.
טיפול חד פעמי - אבל מרתיע
קאסגבי פועלת על ידי עריכת תאי גזע מדם המטופל כך שייצרו רמות גבוהות של "המוגלובין עוברי" - הצורה הבריאה נושאת החמצן של המוגלובין שנוצרת במהלך התפתחות העובר, אך בדרך כלל נסגרת זמן קצר לאחר הלידה. חוקרים זיהו בעבר מוטציה גנטית מסוימת שגורמת להמוגלובין עוברי להימשך בבגרות, וכאשר המוטציה מופיעה באנשים עם אנמיה חרמשית, המחלה שלהם קלה. קאסגבי משתמשת בקריספר כדי לחקות את התהליך הזה.
הטיפול בקאסגבי אמנם חד-פעמי, אולם הוא אינו מהיר או פשוט ויכול להימשך חודשים ועד שנה. המטופלים צריכים לקבל עירויים במשך שמונה שבועות כהכנה לשתי שאיבות של תאי גזע מדמם. בתהליך זה, הקרוי אפרזיס, הדם נשאב מהווריד אל מכונה אשר מפרידה את תאי הגזע לשקית בעוד שאר מרכיבי הדם והפלזמה מוחזרים לחולה. התאים נשלחים לעריכה גנטית והמטופלים נדרשים לעבור כימותרפיה עם תרופה בשם בוסולפאן בזמן שהם מתכוננים לקבלת התאים הערוכים. הטיפול הכימותרפי נועד למחוק את תאי הגזע המקומיים שעלולים להישאר במח העצם של המטופלים, וכך להשאיר מקום במח העצם עבור התאים הערוכים. כמו רוב הכימותרפיות, החולים עלולים לסבול מתופעות לוואי חמורות, ולכן עליהם להיות מאושפזים בתנאים סטריליים, ולהמשיך את האשפוז גם אחרי הזרקת התאים הערוכים עד שהמערכת החיסונית תתאושש - תקופה של ארבעה-שישה שבועות.
הטיפול בקאסגבי מזכיר אמנם השתלת מח עצם, טיפול מקובל ב-30 השנים האחרונות, אך בניגוד להשתלה שבה התאים מגיעים מתורם, כאן מדובר בהשתלה עצמית של תאים שנערכו - מה שמוריד חסמים של מציאת תורם מתאים ומסיר חששות לגבי תגובת הגוף לתאים של אדם אחר.
לפי הערכות של ורטקס, בארה"ב ובאירופה יש כ-32 אלף מועמדים, בדרך כלל חולים עם מקרים חמורים יותר שיהיו מוכנים לעבור את הטיפול - רובם (כ-80%) עם אנמיה חרמשית. בניסויים הקליניים שלהם, השתתפו חולים שחווים בממוצע ארבעה התקפי כאב ושני אשפוזים בשנה. כאשר אנמיה חרמשית מתקדמת ופוגעת באיברים כבר לא ניתן להחזיר את הגלגל לאחור, והאישור שניתן מגיל 12 מיועד כדי להציע אותו למתבגרים וצעירים לפני שהם חווים נזק משמעותי.
למרות ההתקדמות בכלים הטכנולוגיים, עדיין קשה לנבא את ההשלכות הביולוגיות שעלולות להיות לשינויים הגנטיים האלה, וידרשו שנים ארוכות כדי להבין את אותן במלואן. זו אחת השאלות הגדולות שמעסיקות את הרגולטורים. הרגולטור הבריטי החליט שבמקרה של המחלות המדוברות - היתרונות עולים על הסיכונים.
2023-11-19T14:07:59Z dg43tfdfdgfd